蛋白质疗法在复杂疾病的治疗中发挥了不可替代的作用,但是缺乏有效的递送载体,尤其是用于胞内递送功能性蛋白的载体,阻碍了其临床应用。鉴于此,安徽理工大学王文新教授团队采用苯胍基修饰聚β氨基酯的策略,旨在增强其对胞质蛋白递送的适用性。
研究团队系统评价了苯胍基修饰对蛋白质结合、细胞内吞、蛋白功能保护以及溶酶体逃逸的影响。与未修饰的聚β氨基酯相比,富含苯胍基的聚β氨基酯具有更高的蛋白质结合能力和内化效率。此外,两种聚β氨基酯均能够有效递送不同分子量(30-464 kDa)、不同等电点(pI 4.3-9)的多种蛋白质,并且递送效果远超商业化蛋白转染试剂PULsinTM和PierceTM。值得注意的是,富含苯胍基的聚β氨基酯成功将CRISPR Cas9核糖核蛋白递送到表达绿色荧光蛋白的HeLa细胞中,并实现了超过80%的表达敲除。这些结果表明,富含胍基的聚β氨基酯是一种很有前途的蛋白质递送载体,并且有望用于基于蛋白质和核酸酶的基因编辑治疗。
聚β氨基酯的合成路线
线性的聚β氨基酯(PAEs)可通过Michael加成聚合得到。这里,作者基于团队前期工作,使用了优化后的单体配方和聚合物分子量调控策略,得到了一种具有潜在递送蛋白质功能的聚β氨基酯结构(L3)。以L3为原料,与4-胍基苯甲酸(GBA)进一步反应,得到了苯胍基(PG)修饰的聚β氨基酯(L3PG)。
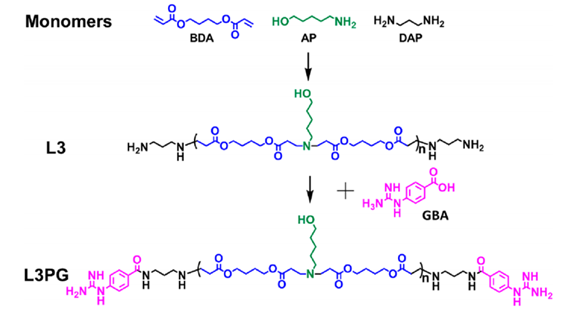
图1 单体和PAEs(L3、L3PG)的结构
聚β氨基酯/蛋白复合物的表征与细胞内吞
首先,作者以牛血清白蛋白(BSA,66 kDa,pI 4.6)作为模型蛋白研究了PAEs的蛋白结合能力。动态光散射(DLS)结果显示,当聚合物与蛋白质量比在5~80之间,L3PG和L3都能与BSA组装形成纳米粒,并且随着质量比增加,纳米粒尺寸也会增大。相比于L3,L3PG表现出更加优异的蛋白结合能力,约95%的蛋白在质量比为20时即可被封装,虽然L3也能达到类似的蛋白封装效率,但质量比却必须增加到30以上。这些结果表明PG修饰有助于提高载体的蛋白结合能力。
接着,作者比较了Hela细胞对两种PAEs/蛋白复合物的内吞差异,激光共聚焦和流式结果都显示L3PG/蛋白复合物具有更高的细胞摄取量。因此,可以证明L3PG在蛋白质内化方面更具优势。
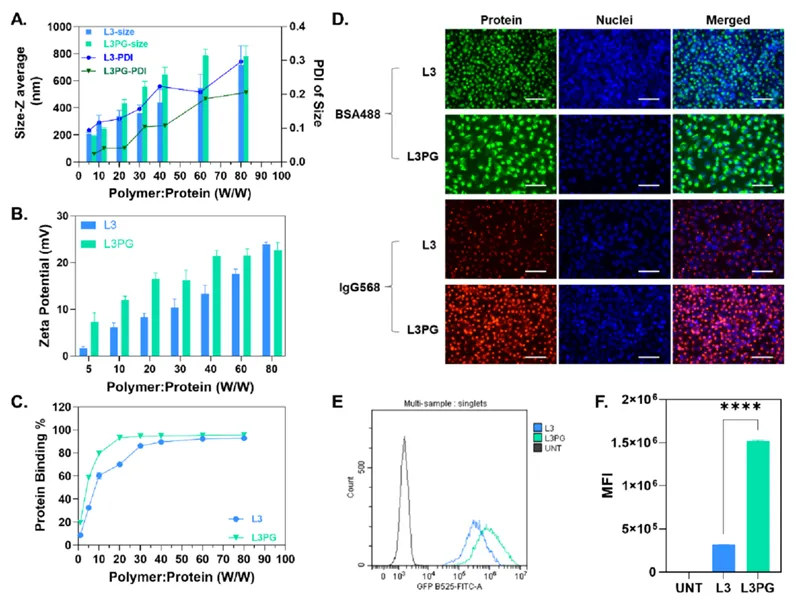
图2 PAEs/蛋白复合物的表征和细胞内吞
聚β氨基酯/蛋白复合物的内吞途径和溶酶体逃逸
聚合物载体通常是通过内吞作用进入细胞,但也有研究提出胍基功能化的载体可以穿透细胞膜进入细胞。因此,为了确定PAEs/蛋白复合物的内吞途径,作者使用了不同的内吞抑制剂和膜融合抑制剂来进行研究。实验结果表明,无论是否有PG修饰,PAEs/蛋白复合物都主要通过网格蛋白介导的内吞作用进入细胞,小部分也会通过小窝蛋白介导的内吞作用以及微胞饮作用进入细胞。
溶酶体捕获是胞内递送的主要障碍,它会限制蛋白药物运输到靶点,从而降低疗效,因此理想的蛋白递送载体应该具有较好的溶酶体逃逸能力。基于此,作者首先对Hela细胞与PAEs/BSA-FITC复合物共孵育4 h后拍摄的激光共聚焦成像图进行了共定位分析,计算了BSA-FITC与溶酶体的共定位系数,结果显示两种PAEs/BSA-FITC复合物被Hela细胞内吞4 h后均部分位于溶酶体中,且共定位系数相近。为了进一步评估PAEs/蛋白复合物的溶酶体逃逸能力,作者在HEK-Gal8YFP细胞上观察了两种PAEs/蛋白复合物对内体的破坏水平。半乳糖凝集素8(Gal8)是一种分散在细胞质中的蛋白,当内体被破坏时,Gal8会重新分布并与内体内膜上的糖基化组分结合,因此作者这里通过将荧光蛋白与Gal8融合的方法,就可以半定量地评估内体的完整性。作者用共聚焦显微镜分别观察了HEK-Gal8YFP细胞与PAEs/BSA复合物共孵育2、4 h后的荧光成像结果,发现同一个时间点,L3组和L3PG组处理的细胞之间YFP荧光点数目没有显著差异,但L3组处理的细胞其表达YFP的荧光强度却明显高于L3PG组。从孵育2 h后的HEK-Gal8YFP细胞的荧光成像图中也可以看到,经L3组处理后的细胞内出现了更亮、更大的YFP荧光点。这些结果表明L3的内体/溶酶体逃逸能力略高于L3PG。值得注意的是,共孵育2 h后细胞内观察到强烈的内体破坏活性,这说明PAEs/蛋白复合物能够迅速从内体/溶酶体逃逸并避免蛋白降解。
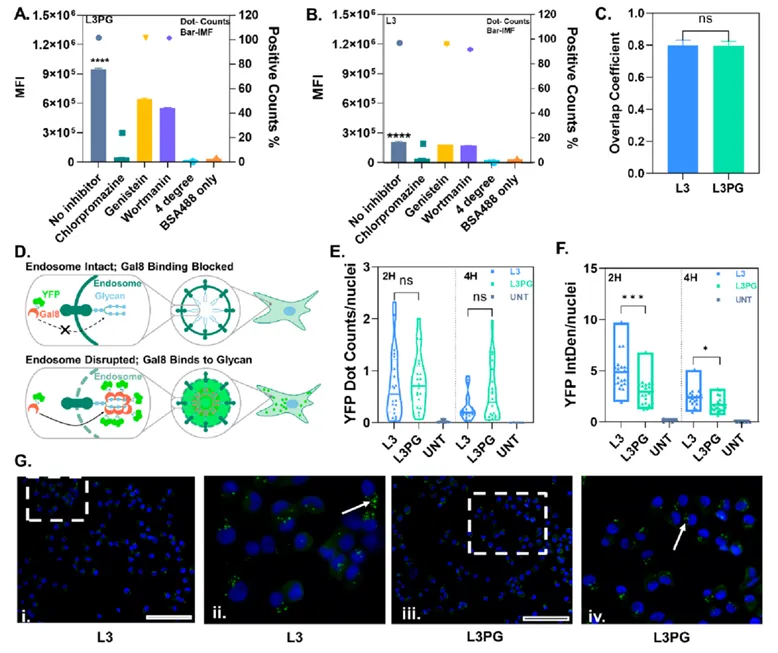
图3 PAEs/蛋白复合物的内吞途径和溶酶体逃逸行为
聚β氨基酯用于功能性蛋白的胞内递送
与核酸不同,蛋白质的生物活性可能会在与聚合物的结合或解离过程中被破坏,因此载体对蛋白功能的保护也很关键。这里,作者通过递送一种酶蛋白,即β-半乳糖苷酶(β-Gal)来研究PAEs对蛋白活性的保护能力,β-Gal是一种带负电荷的大蛋白(464 kDa,pI 4.6),可以催化多种β-半乳糖苷的水解。为了评价β-Gal的生物活性,作者以商业化蛋白转染试剂PULsinTM和PierceTM作为阳性对照,将无色的5-溴-4-氯-3-吲哚半乳糖苷(X-Gal)底物加入到被不同载体转染处理后的Hela细胞中,发现L3组、L3PG组和PierceTM组处理后的细胞被染成深蓝色,表明β-Gal在经过这三组处理后依旧能保持较强的生物活性,而PULsinTM组处理的细胞只被染成了微弱的蓝色,阴性组的细胞根本没有被染色。此外,作者还通过另外两种底物:邻硝基苯-β-半乳糖苷(ONPG)和荧光素脱脂酶(FDG),进一步证明了经两种PAEs组转染处理后的HeLa细胞中的β-Gal都能保持较好的生物活性,甚至远超过商业化蛋白转染试剂组的活性,并且PG修饰使PGL3具有更优越的蛋白活性保护能力。
虽然已经证明了PAEs能够保护蛋白的生物活性,但其将功能蛋白递送到靶点并发挥作用的能力仍有待进一步证实。因此,作者选择皂孢菌素(SAP)作为模型蛋白药物,这是一种核糖体非活性酶(30 kDa, pI 9),可用于抗癌研究与治疗。实验结果发现,游离的SAP对Hela细胞的细胞毒性较低,而L3PG/SAP组和L3/SAP组都能显著杀伤细胞,并且细胞毒性远高于商业化蛋白转染试剂/SAP组。这些结果初步表明,PAEs可以作为一种通用型载体用于有效递送不同分子量、不同等电点的多种蛋白质并实现其治疗效果。
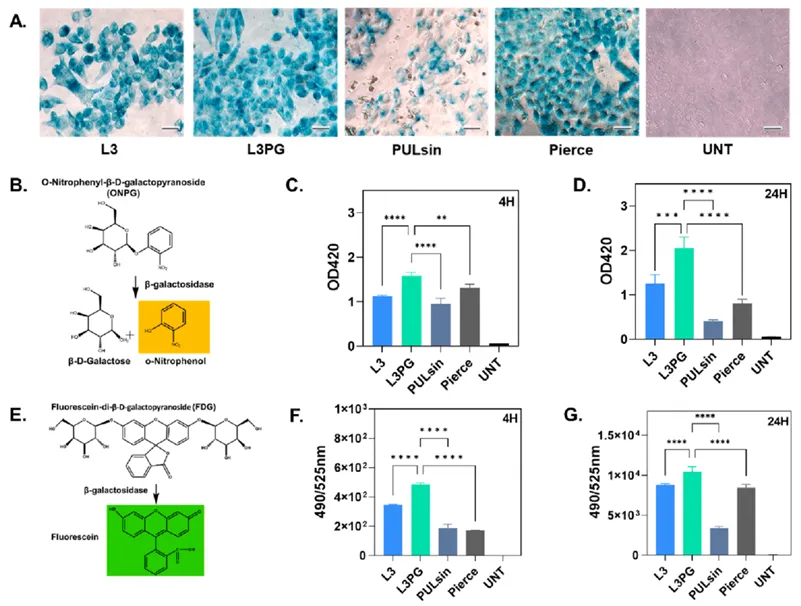
图4 HeLa细胞中PAEs/β-Gal的递送效果
聚β氨基酯用于基于CRISPR/Cas9核糖核蛋白的基因编辑
为了进一步证明PAEs是一种通用型蛋白质递送载体,作者将PAEs用于CRISPR/Cas9核糖核蛋白(RNP)的递送,并进一步实现基因编辑。作者在GFP表达的HeLa细胞系(HeLa-GFP)中设计了一段用于GFP基因敲除的引导RNA(sgRNA),并通过电穿孔法进行了验证。Sanger测序结果显示电穿孔法介导下约80%的靶点都被敲除,经过L3PG/RNP复合物和L3/RNP复合物转染细胞分别能够实现19%和6%的靶点敲除,而商业化CRISPR/Cas9 RNP递送试剂脂质体(CMAX)则实现了20%的靶点被敲除。T7内切酶I(T7E1)法的实验结果进一步证实了上述目标基因编辑情况。与L3PG组相比,L3组只参与了少数的基因编辑,这表明PG修饰不仅增强了PAEs与蛋白质之间的相互作用,而且还提高了RNP复合物中sgRNA的稳定性。通过检测处理后HeLa-GFP中的GFP表达水平,发现与未处理的HeLa-GFP细胞相比,L3PG组的GFP表达减少了83%,而L3组和CMAX组的GFP表达分别减少了73%和52%。虽然所有试剂处理的细胞都具有良好的细胞活力,但作者也观察到使用PAEs转染会导致细胞损伤和增殖,进而导致GFP可能在细胞分裂过程中丢失,造成相应细胞样品中观察到的荧光强度降低,这也解释了为什么CMAX组的基因编辑效率虽高于APEs组,但最后GFP表达的下调量反而低于APEs组。
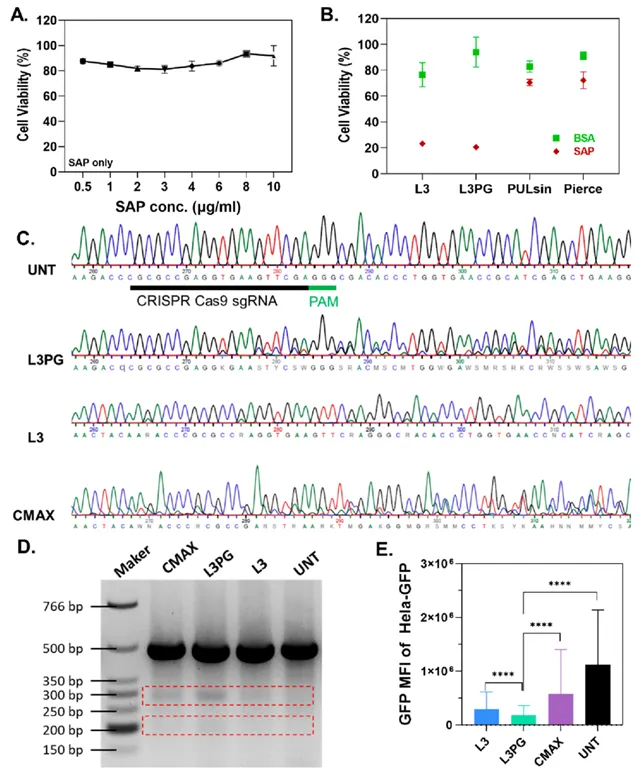
图5 PAEs用于递送SAP和CRISPR RNP
全文总结
作者报道了一种经理性设计、富含胍基的聚β氨基酯材料,它可以作为一种通用型胞内递送载体用于有效递送不同分子量、不同等电点的多种蛋白质。苯胍基修饰不仅可以增强聚β氨基酯与蛋白质之间的相互作用,而且还有助于保持功能蛋白的生物活性并提高蛋白内化效率。综上所述,富含胍基的聚β基酯是一种很有前途的蛋白质递送载体,并且有望用于基于蛋白质和核酸酶的基因编辑治疗。